






Porta Camillo
Γλώσσα
Αγγλική
Ημερομηνία
11/03/2011
Διάρκεια
24:29
Εκδήλωση
5ο Μετεκπαιδευτικό Σεμινάριο Ουρολογικού Καρκίνου
Χώρος
Ξενοδοχείο The Athens Hilton
Διοργάνωση
Ελληνική Συνεργαζόμενη Ογκολογική Ομάδα (HECOG)
Θεραπευτική Κλινική Πανεπιστημίου Αθηνών-Γενικό Νοσοκομείο "Αλεξάνδρα"
Β' Παθολογική Κλινική - Γενικό Νοσοκομείο Αθηνών "Ιπποκράτειο" – Εθνικό και Καποδιστριακό Πανεπιστήμιο Αθηνών
Α' Πανεπιστημιακή Ουρολογική Κλινική-"Λαϊκό" Γενικό Νοσοκομείο Αθηνών – Εθνικό και Καποδιστριακό Πανεπιστήμιο Αθηνών
Β' Πανεπιστημιακή Ουρολογική Κλινική - Γενικό Νοσοκομείο Αττικής Σισμανόγλειο – Αμαλία Φλέμινγκ – Εθνικό και Καποδιστριακό Πανεπιστήμιο Αθηνών
Β' Ογκολογική Κλινική - Θεραπευτήριο "Metropolitan"
Κατηγορία
Ογκολογία
Ετικέτες
ανθεκτικότητα, αντι-αγγειογενητικές θεραπείες, VEGF, FGF2, ιντερλευκίνη-8, αγγειποποιητίνη, μετάσταση
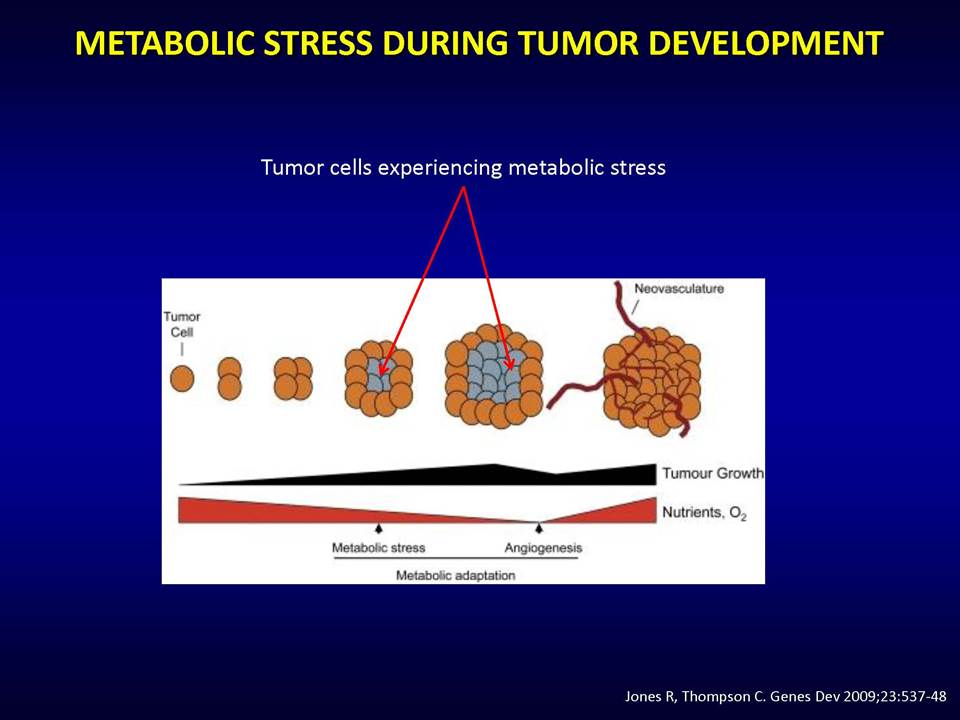
Οι συμπαγείς όγκοι καταναλώνουν κατά τη διάρκεια της ανάπτυξής τους τις πηγές θρεπτικών ουσιών και οξυγόνου, πράγμα το οποίο τους οδηγεί σε μεταβολικό στρες. Αυτό έχει σαν συνέπεια τα καρκινικά κύτταρα να περνούν μια περίοδο μεταβολικής προσαρμογής, κατά τη διάρκεια της οποίας είτε θα επιβιώσουν είτε θα οδηγηθούν σε απόπτωση. Η δημιουργία νέων αγγείων, αποτελεί μία από τις στρατηγικές που χρησιμοποιούν οι συμπαγείς όγκοι για να αντεπεξέλθουν στο μεταβολικό στρες.
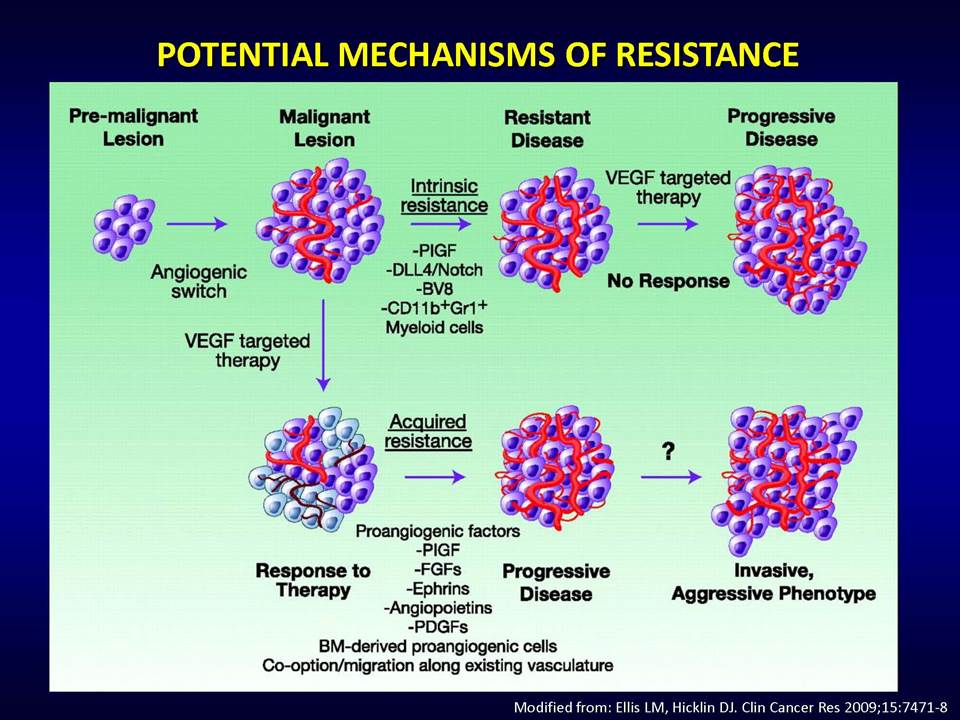
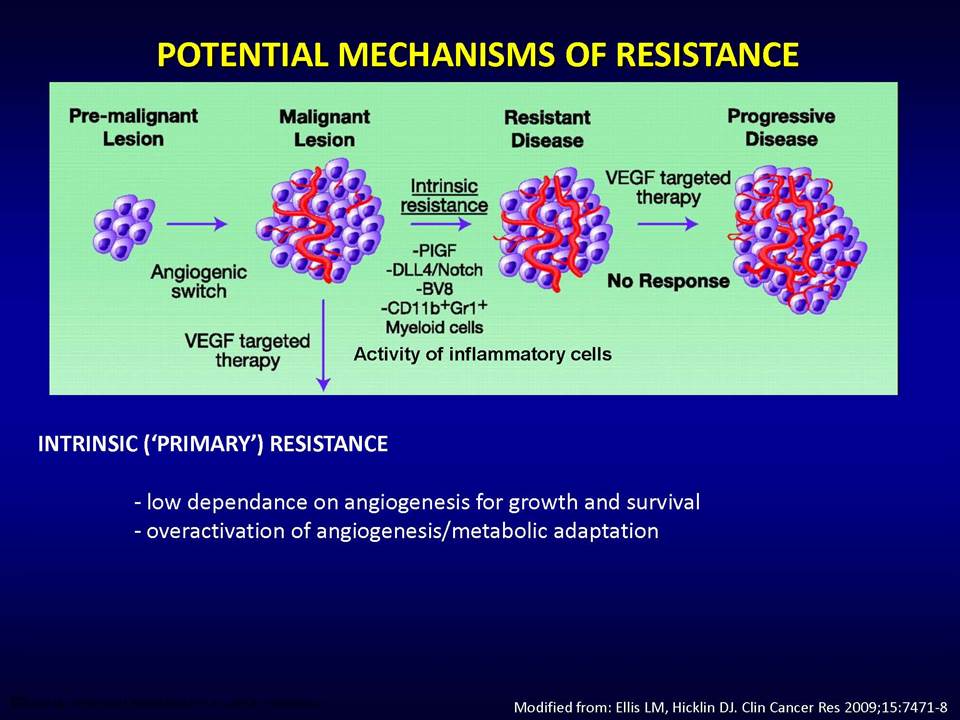
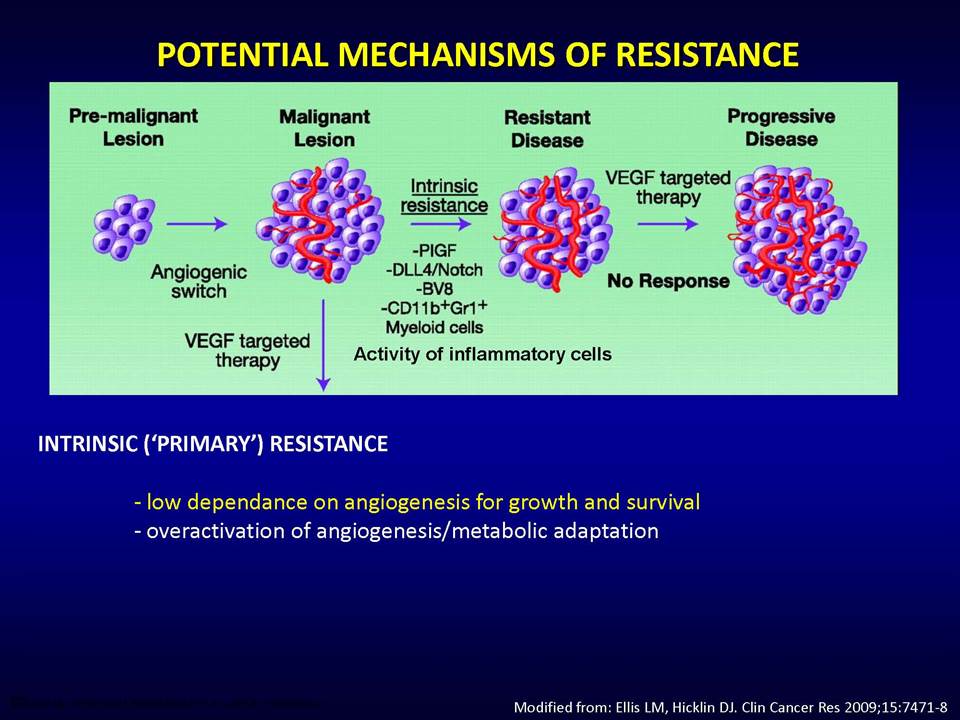
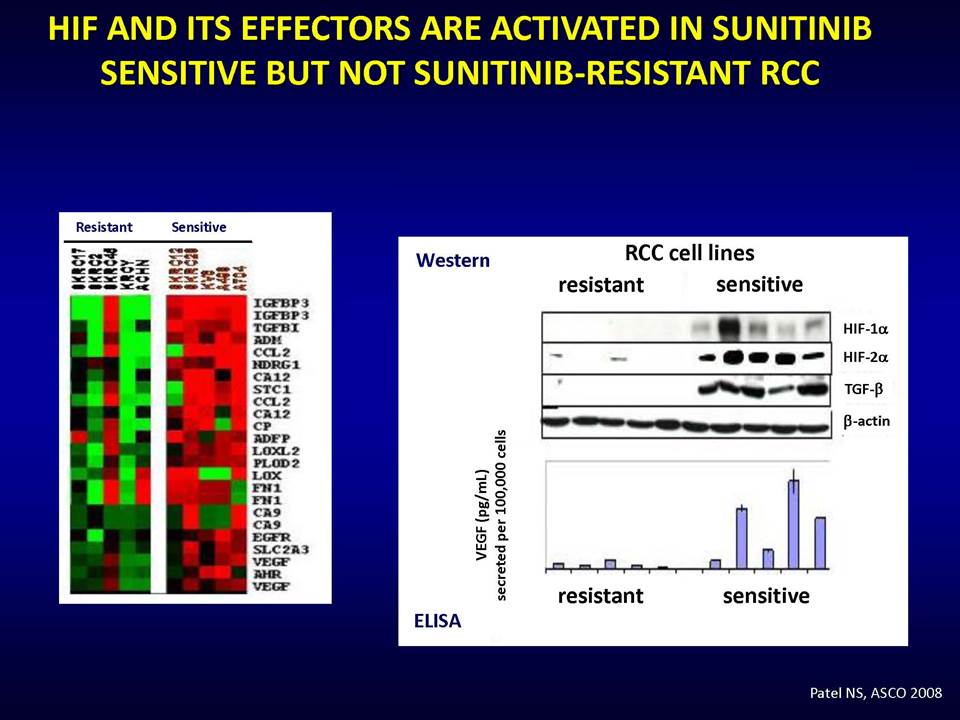
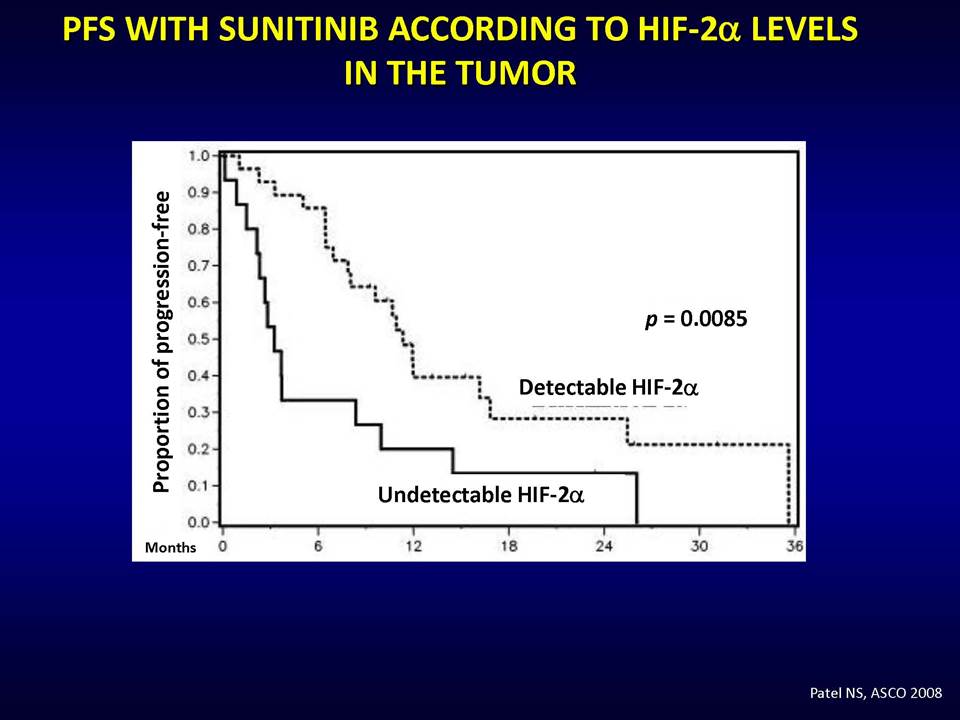
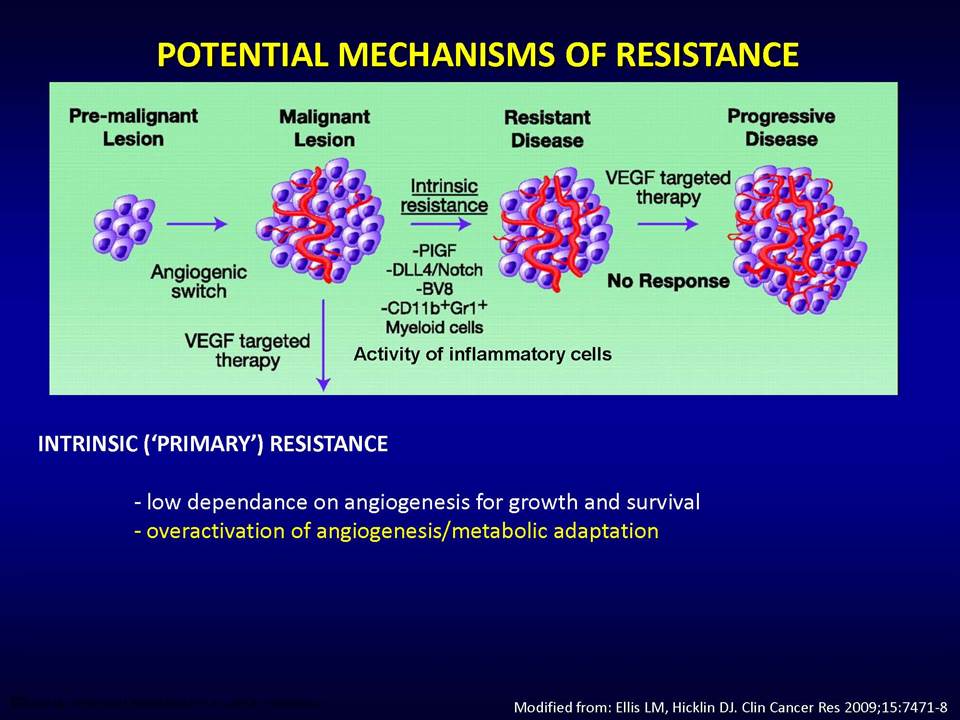
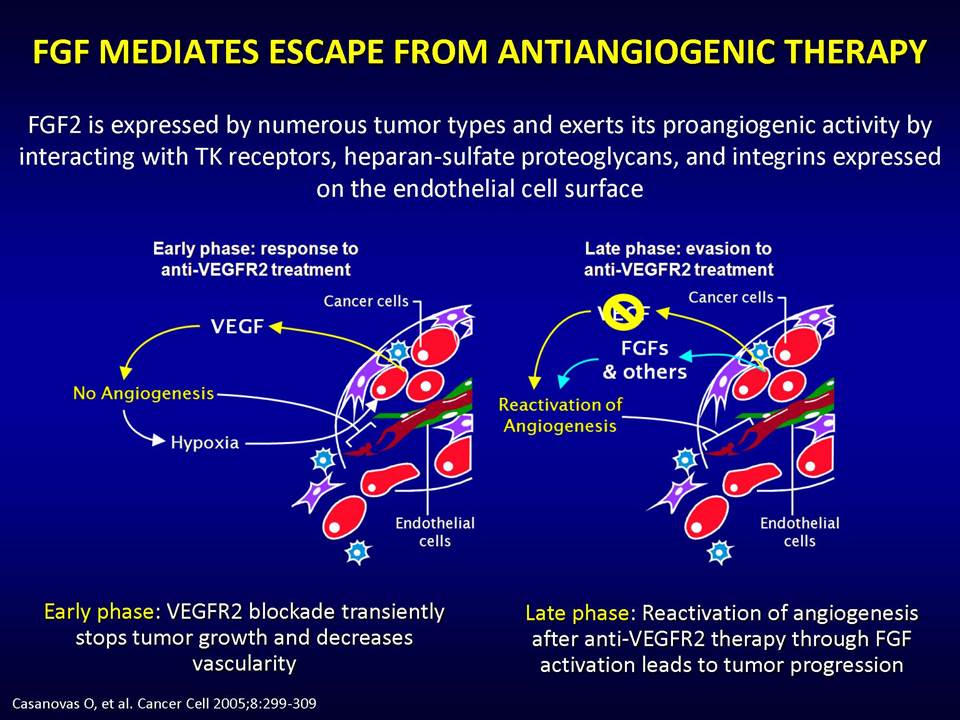
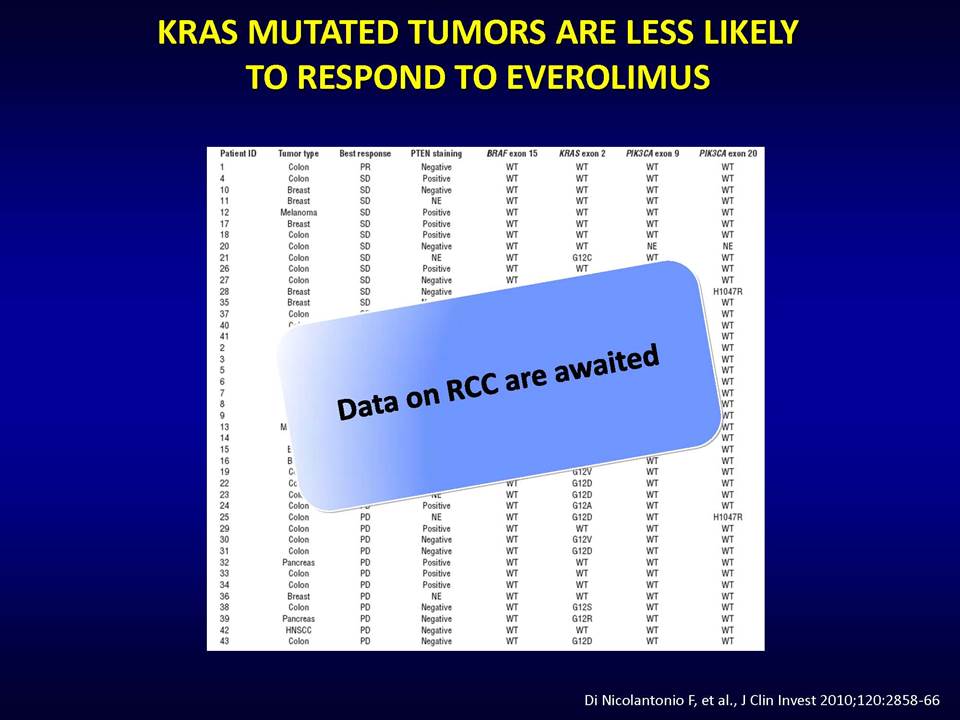
Οι στοχευμένες αντι-αγγειογενητικές θεραπείες αποβλέπουν ακριβώς στο να εμποδίσουν τους όγκους να έχουν πρόσβαση σε νέες τροφικές πηγές, μέσω της παρεμπόδισης της διαδικασίας σχηματισμού νέων αγγείων. Ειδικότερα, οι θεραπείες αυτές στοχεύουν το μονοπάτι του αγγειακού ενδοθηλιακού αυξητικού παράγοντα (vascular epithelial growth factor, VEGF). Ωστόσο, η κλινική πρακτική έχει δείξει ότι οι όγκοι αναπτύσσουν ανθεκτικότητα σε αυτές.
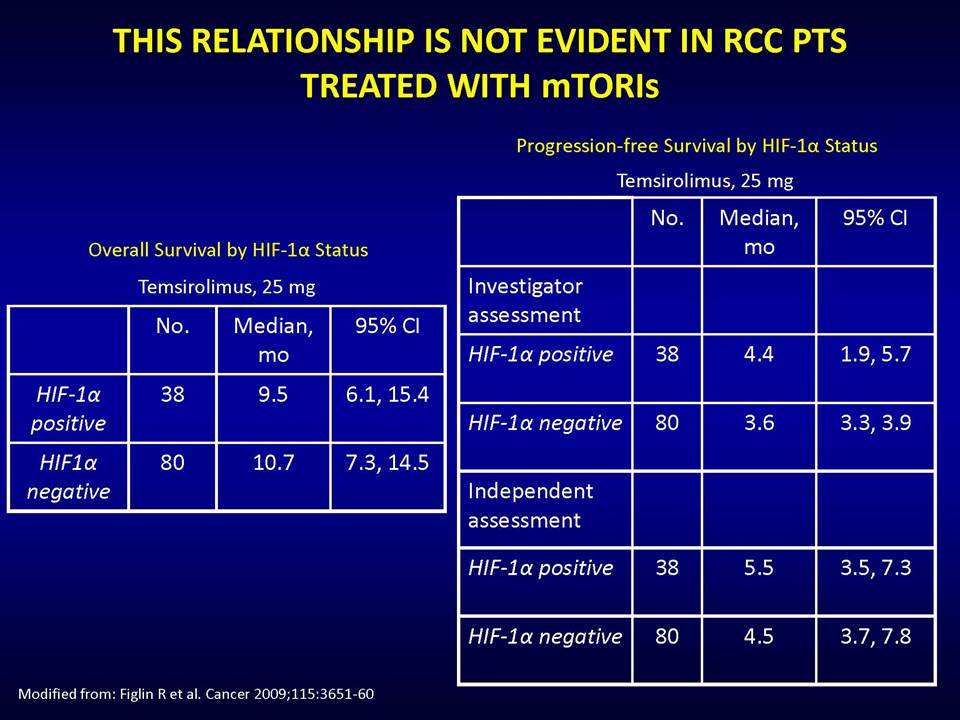
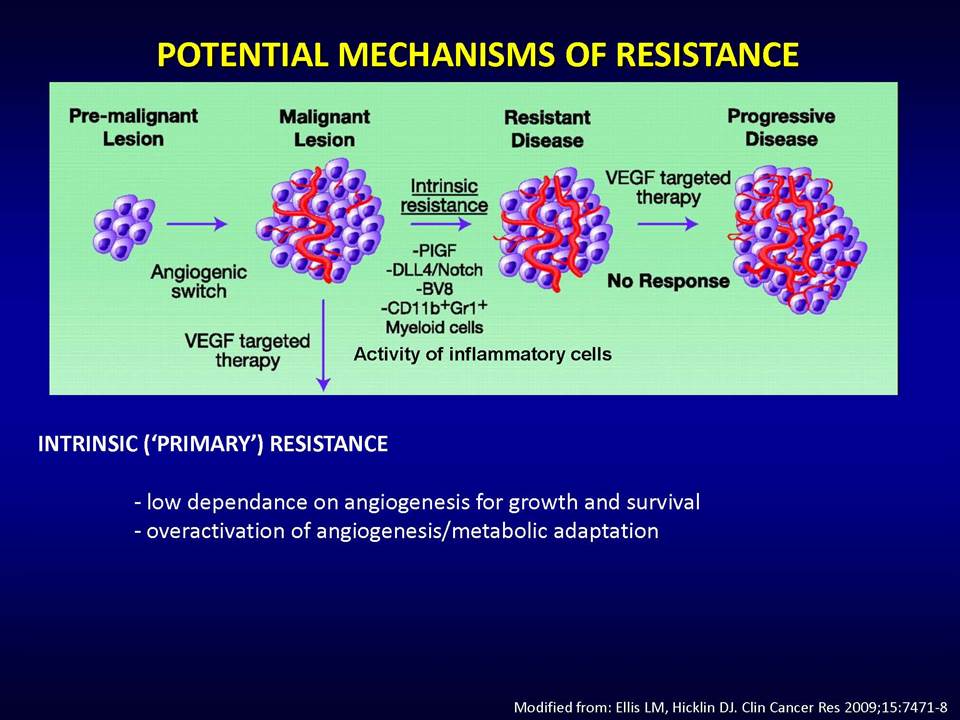
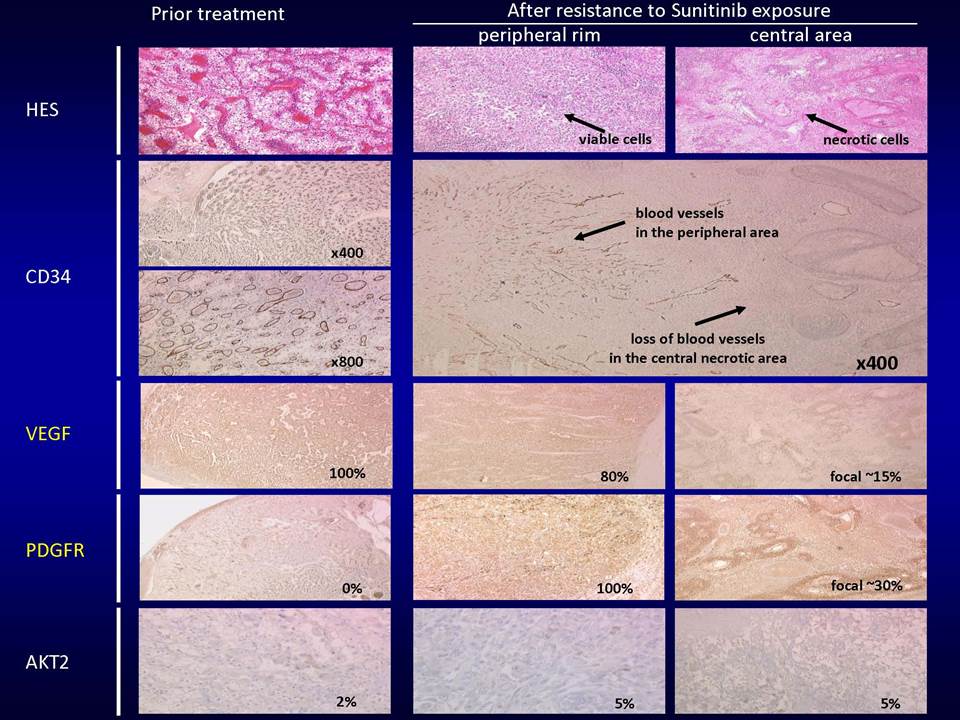
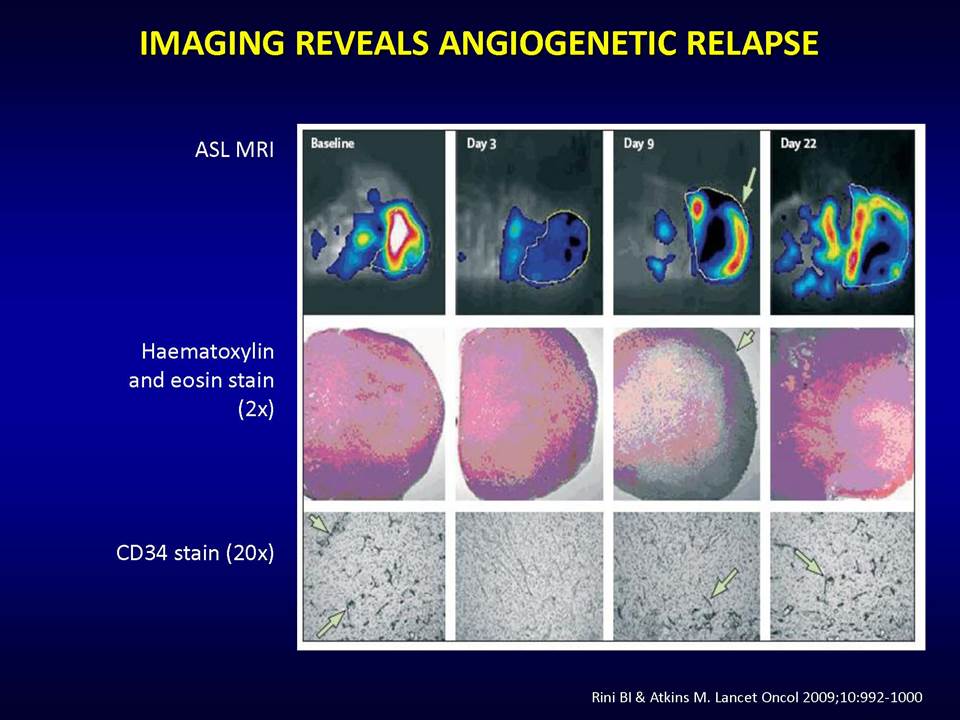
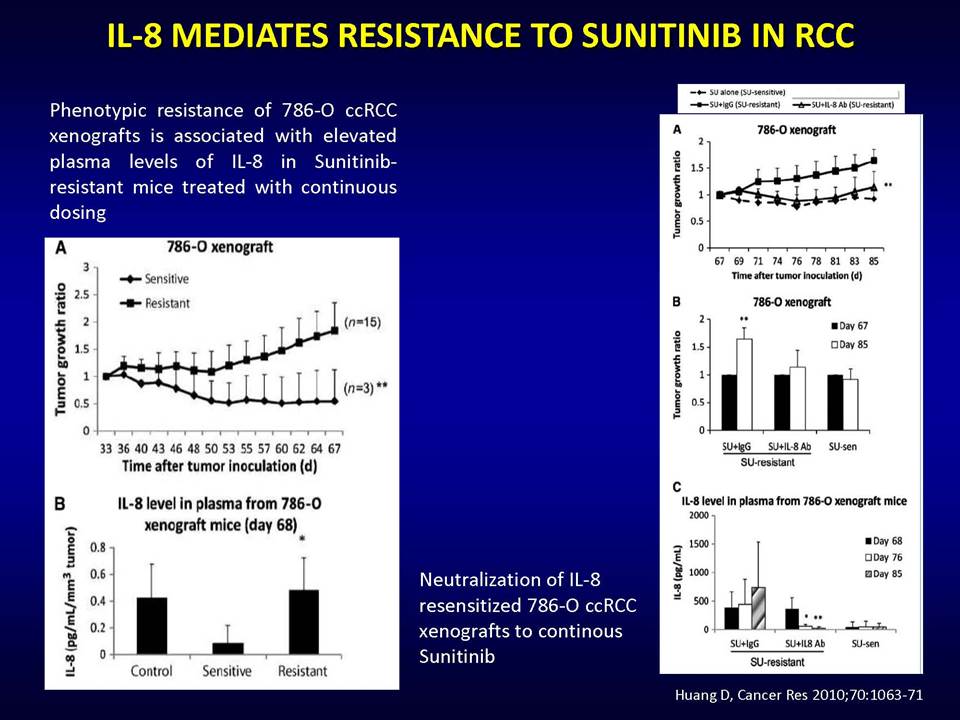
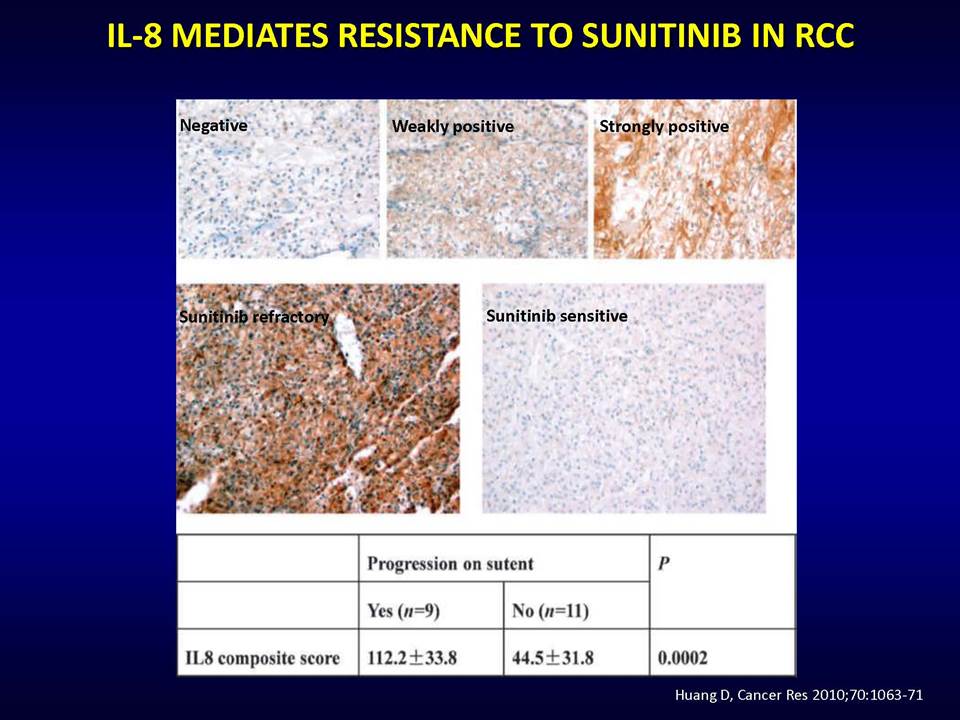
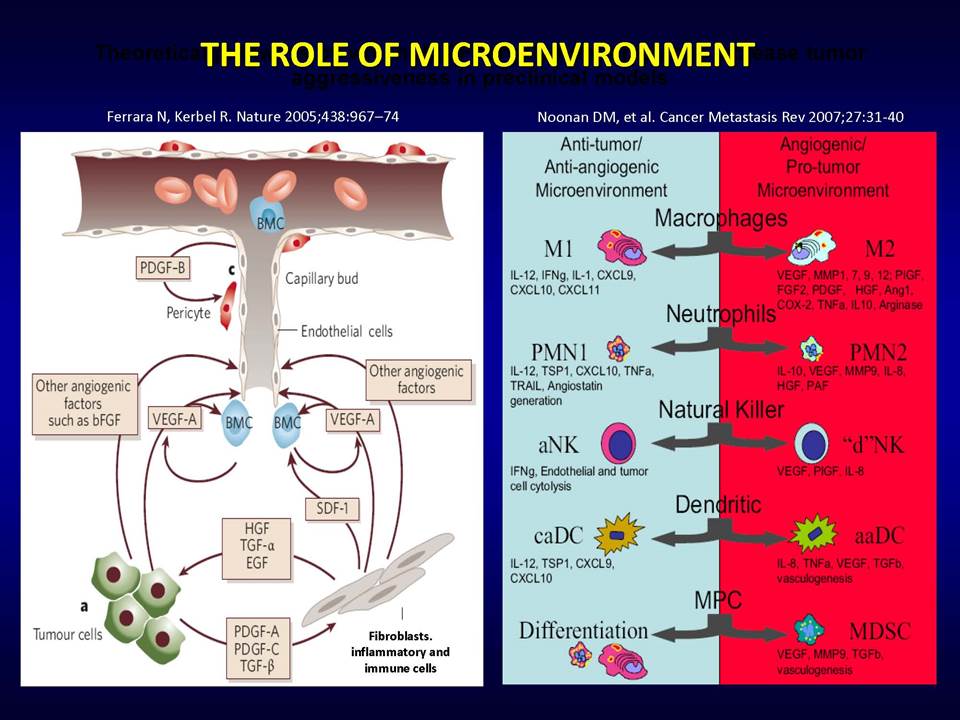
Δυνητικοί μηχανισμοί μέσω των οποίων οι όγκοι αναπτύσσουν ανθεκτικότητα στις παραπάνω στοχευμένες θεραπείες, είναι:1) η ενεργοποίηση εναλλακτικών μονοπατιών αγγειογένεσης (π.χ αυξητικού παράγοντα ινοβλαστών FGF2, ιντερλευκίνης-8, αγγειοποιητίνης), 2) η προσέλκυση κυττάρων από το μικροπεριβάλλον τους (π.χ μυελού των οστών), τα οποία υποστηρίζουν τα καρκινικά κύτταρα και ενισχύουν την αγγειογένεση ακόμη και παρουσία αντι-αγγειογενητικών θεραπειών, 3) η ενεργοποίηση μεταστατικών μηχανισμών οι οποίοι εξασφαλίζουν διαφυγή κυττάρων (μέσω των υπαρχόντων αγγείων) προς άλλους ιστούς.
Ολοένα και περισσότερα δεδομένα υποδεικνύουν το βασικό ρόλο του μικροπεριβάλλοντος των όγκων στην απόκτηση ανθεκτικότητας, πράγμα το οποίο πρέπει να ληφθεί σοβαρά υπ' όψιν στην προσπάθεια ανάπτυξης αποτελεσματικότερων θεραπειών.
Ο Camillo Porta είναι Ογκολόγος στο Πανεπιστημιακό Νοσοκομείο I.R.C.C.S San Matteo και καθηγητής Ιατρικής Ογκολογίας στην Σχολή Βιοτεχνολογίας του Πανεπιστημίου της Παβίας στην Ιταλία. Απόφοιτος της Ιατρικής Σχολής του ιδίου Πανεπιστημίου και με ειδίκευση στην Κλινική Ογκολογία, ο καθηγητής Porta έχει λάβει τιμητικές διακρίσεις για το ερευνητικό και το κλινικό έργο του. Στα ερευνητικά ενδιαφέροντά του συγκαταλλέγονται η ανοσολογία των όγκων, η βιολογία του νεφρικού καρκινώματος, η βιολογία του κακοήθους μεσοθηλιώματος, η πήξη του αίματος και η σχέση της θρόμβωσης με τον καρκίνο, καθώς και η ανάπτυξη αντικαρκινικών φαρμάκων. Λαμβάνει μέρος σε κλινικές δοκιμές αντικαρκινικών φαρμάκων για το γαστρενερικό και το ουροποιητικό σύστημα, καθώς επίσης και στην ανάπτυξη κυτταρικών θεραπειών για την αντιμετώπιση των όγκων. Εχει δημοσιεύσει περισσότερα από 120 ερευνητικά άρθρα και είναι αρχισυντάκτης της επιστημονικής επιθεώρησης Oncology Reviews.
Drug resistance by evasion of antiangiogenic targeting of VEGF signaling in late-stage pancreatic islet tumors. Cancer Cell, Elsevier, 2005, Vol. 8(4), pp. 299-309